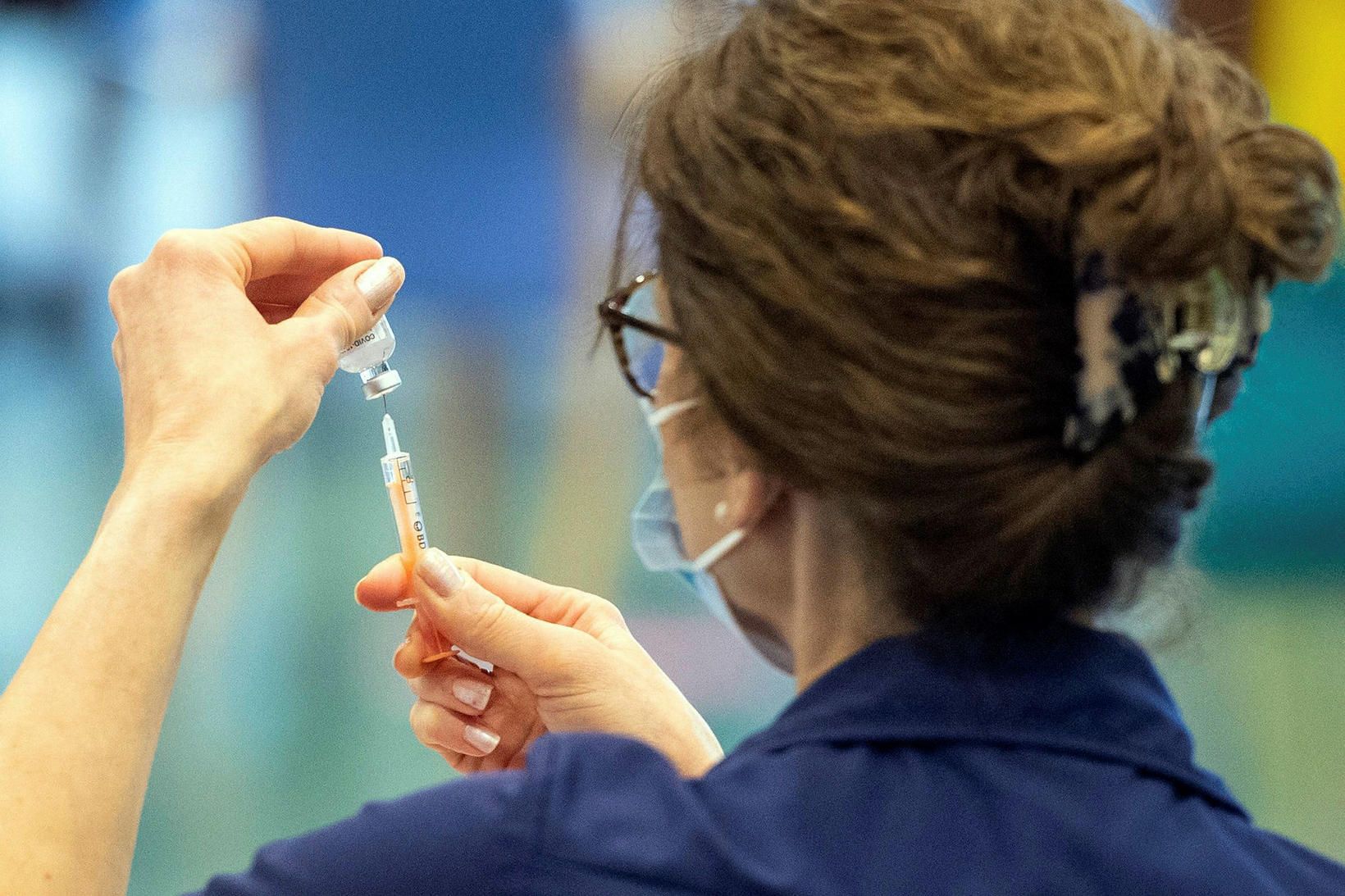
Bóluefnið fær flýtimat hjá EMA
Lyfjastofnun Evrópu (EMA) hefur borist umsókn um skilyrt markaðsleyfi fyrir bóluefni gegn Covid-19 sem þróað hefur verið af lyfjafyrirtækinu AstraZeneca og Oxford-háskóla. Bóluefnið kallast Covid-19 Vaccine AstraZeneca og mun EMA meta það í flýtimati. Niðurstaða um hvort EMA mæli með útgáfu markaðsleyfis fyrir bóluefnið gæti legið fyrir 29. janúar þegar sérfræðinganefnd EMA um lyf fyrir menn (CHMP) fundar.
Til að svo geti orðið þurfa umsóknargögnin að sýna með fullnægjandi hætti fram á gæði, öryggi og virkni bóluefnisins. Reynist einhver gögn skorta þurfa þau jafnframt að berast EMA hratt til að matinu geti lokið umræddan dag. Þetta kemur fram á vef Lyfjastofnunar.
Bóluefni Moderna komið til landsins
Tvö bóluefni hafa verið samþykkt af Lyfjastofnun til notkunar á Íslandi með útgáfu skilyrts markaðsleyfis. Annars vegar er það bóluefnið Comirnaty frá BioNTech og Pfizer. Hins vegar bóluefnið COVID-19 Vaccine Moderna frá Moderna. Grundvöllur markaðsleyfis beggja bóluefnanna er ítarlegt mat Lyfjastofnunar Evrópu á virkni, öryggi og gæðum bóluefnisins.
Tvö önnur bóluefni eru í flýtimati hjá Lyfjastofnun Evrópu, svokölluðu áfangamati, en um er að ræða bóluefni frá AstraZeneca og Janssen-Cilag.
Bóluefni Moderna kom til landsins í morgun og verður væntanlega byrjað að bólusetja með því á morgun. Ef bóluefni AstraZeneca fær samþykki þá verður það væntanlega þriðja bóluefnið sem kemur hingað til lands en bólusetningar hófust með bóluefni PfizerBioNTech í síðustu viku ársins 2020. Bólusetja þarf tvisvar með öllum bóluefnunum þremur en geymsluþol þeirra er ólíkt.
Dugar fyrir 115 þúsund einstaklinga
Samningar um innkaup bóluefna gegn Covid-19 eru á höndum heilbrigðisráðuneytisins. Framkvæmd bólusetninga er á forræði sóttvarnalæknis hjá embætti landlæknis.
Samningur Íslands við AstraZeneca var undirritaður 15. október 2020. Ísland fær um 230.000 skammta sem duga fyrir um 115.000 einstaklinga. Komutími óviss en Astra Zeneca stefnir að því að byrja að afhenda skammta í Evrópu á fyrsta ársfjórðungi.
Forsenda þess að hægt er að meta bóluefnið eins hratt og raun ber vitni er að nú þegar hefur töluvert magn gagna um lyfið verið metið í svokölluðu áfangamati. EMA getur beitt því til að flýta fyrir matsferli vænlegra lyfja eða bóluefna þegar alvarleg heilsuvá er komin upp. Alla jafna þurfa lyfjafyrirtæki að senda inn öll gögn um virkni, öryggi og gæði lyfja áður en mat á þeim hefst, en í áfangamati eru gögnin metin eftir því sem þau verða tiltæk.
Í áfangamati bóluefnis AstraZeneca lagði EMA mat á niðurstöður rannsókna á tilraunastofum, rannsókna á gæðum bóluefnisins (innihaldsefnum og framleiðsluaðferðum) og gögn um öryggi og virkni þess úr samantektargreiningu (e. pooled analysis) fjögurra rannsókn í Bretlandi, Brasilíu og Suður-Afríku sem ekki var þá lokið. EMA hafa nú borist frekari gögn um gæði, öryggi og virkni bóluefnisins frá fyrirtækinu og stendur mat á þeim yfir.
Íslenskt markaðsleyfi eins fljótt og auðið er
Skilyrt markaðleyfi gera lyfjayfirvöldum í EES ríkjum mögulegt að flýta aðgengi að lyfjum þegar brýn þörf er á þeim, til dæmis í neyðarástandi eins og yfirstandandi heimsfaraldur hefur skapað. Undir slíkum kringumstæðum liggur fyrir minna magn rannsóknargagna um lyfin en þegar um hefðbundin markaðsleyfi er að ræða, en umsækjanda er gert að skila frekari gögnum síðar.
„Skilyrt markaðsleyfi er þannig veitt ef ávinningur af því að lyf eða bóluefni sé aðgengilegt sem fyrst er meiri en áhættan af því að einhver gögn um viðkomandi lyf séu ekki enn tiltæk. Hins vegar þurfa fyrirliggjandi að sýna svart á hvítu að ávinningur lyfjanna/bóluefnanna sé meiri en áhættan af notkun þeirra. Útgáfa skilyrtra markaðsleyfa tryggir að umrædd lyf/bóluefni uppfylli fyllstu kröfur EES-ríkja um öryggi, virkni og gæði og að þau séu framleidd á samþykktum og vottuðum framleiðslustöðum þar sem lyfjafræðileg gæði eru tryggð. Eftir að skilyrt markaðsleyfi hafa verið veitt þurfa lyfjafyrirtæki að senda inn viðbótargögn úr rannsóknum innan fyrirframskilgreindra tímamarka. Þessi gögn þurfa að staðfesta að ávinningur lyfjanna sé meiri en áhættan af notkun þeirra,“ segir á vef Lyfjastofnunar.
Meti EMA umsókn AstraZeneca þannig að að ávinningur af notkun bóluefnisins sé meiri en áhættan sem henni fylgir, mun stofnunin mælast til útgáfu skilyrts markaðsleyfis. Því næst myndi framkvæmdastjórn Evrópusambandins flýta sínu ákvarðanaferli með það að leiðarljósi að gefa út skilyrt markaðsleyfi á fáeinum dögum. Að útgefnu markaðsleyfi framkvæmdastjórnarinnar mun Lyfjastofnun gefa út íslenskt markaðsleyfi eins fljótt og auðið er.
Eins og gildir um öll lyf munu yfirvöld í Evrópu safna upplýsingum um bóluefni gegn COVID-19 eftir að þau koma á markað og grípa til ráðstafana sé þörf á því. Til er sérstök áætlun um vöktun bóluefna gegn COVID-19, en í henni er kveðið á um örari vöktun en venjulega og sértækar aðgerðir sem snúa að bóluefnunum. Sem dæmi má nefna að fyrirtækjum verður gert að senda inn mánaðarlegar öryggisskýrslur til viðbótar við hefðbundnar upplýsingar sem lög og reglugerðir kveða á um. Jafnframt verður fyrirtækjunum gert að framkvæma rannsóknir til að meta virkni og öryggi bóluefnanna eftir að þeim hefur verið veitt leyfi.
Þessar ráðstafanir gera yfirvöldum kleift að meta hratt og örugglega margvísleg gögn og gera viðeigandi ráðstafanir til að tryggja heilsu almennings reynist þörf á því.
Sýna sterk ónæmisviðbrögð
Á Vísindavef Háskóla Íslands segir svo um bóluefni bóluefni AstraZeneca og Oxford-háskóla: er simpansa-adenóveiruferja (ChAdOx1) sem getur ekki fjölgað sér en ber gen sem skráir fyrir broddprótíni SARS-CoV-2-veirunnar.
Fasa 1 og 2 rannsóknir á bóluefninu hafa sýnt sterk ónæmissvör hjá 18-55 ára og 56 ára og eldri einstaklingum, bæði myndum hlutleysandi mótefna og virkjun T-frumna (28, 29).
Í fasa 3 rannsókn voru tveir skammtar af ChAdOx1 nCoV-19-bóluefninu eða viðmiðunarbóluefni gegn meningókokkasjúkdómi gefnir 23.848 þátttakendum í Bretlandi, Brasilíu og Suður-Afríku með fjögurra vikna millibili. Bráðabirgðamat á vernd byggir á 11.636 þátttakendum (7.548 í Bretlandi og 4.088 í Brasilíu).
Vernd gegn Covid-19 sjúkdómi var 62,1% hjá þátttakendum sem fengu tvo staðlaða skammta, 27 (0,6%) af 4440 sem fengu ChAdOx1 nCoV-19-bóluefnið veiktust, en 71 (1,6%) af 4.455 í viðmiðunarhópi. Meðal 23% þátttakenda sem fengu hálfan staðalskammt fyrst en fullan skammt síðar var verndin gegn COVID-19-sjúkdómi 90,0%, þar sem 3 (0,2%) af 1.367 sem fengu bóluefnið veiktust, en 30 (2,2%) af 1.374 í viðmiðunarhópi. Í rannsókninni í heild var verndin 70,4%. Tíu voru lagðir inn á sjúkrahús, tveir þeirra alvarlega veikir og einn lést, enginn þeirra hafði fengið bóluefnið gegn Covid-19. Einnig eru vísbendingar um að einhver vernd komi fram strax eftir fyrsta skammt af bóluefninu.
Hjá 168 þátttakendum komu fram 175 alvarlegar aukaverkanir, 84 hjá þeim sem fengu ChAdOx1 nCoV-19-bóluefnið og 91 í viðmiðunarhópnum. Öryggismynstur ChAdOx1 nCoV-19-bóluefnisins telst ásættanlegt og bráðabirgðaniðurstöður sýna góða vernd gegn COVID-19-sjúkdómi (30). Í breska hluta rannsóknarinnar voru tekin nef-/hálsstroksýni vikulega og verður hægt að meta hvort bólusetningin verndi gegn sýkingu og smiti, auk þess að vernda gegn sjúkdómnum.
„Fasa 3 rannsóknir halda áfram og rannsókn á vernd hjá 12-18 ára er hafin og til stendur að prófa ólíka skammta af bóluefninu í rannsókn í Bandaríkjunum. Þetta bóluefni má flytja og geyma við 2-8°C, sem er ekki síst kostur fyrir notkun í lág- og meðaltekjulöndum þar sem innviði skortir oft,“ segir á Vísindavefnum en svarið er frá 30. desember 2020.
Hvernig er gert ráð fyrir að bóluefnið virki?
Talið er að bóluefnið virki með því að undirbúa líkamann til að verjast sýkingu af völdum kórónuveirunnar SARS-CoV-2. Veiran notfærir sér „gaddaprótein“ á yfirborði sínu (e. spike proteins) til að komast inn í frumur líkamans og valda sjúkdómi.
Bóluefnið inniheldur adenóveiru sem breytt hefur verið á þann veg að hún inniheldur genaupplýsingar til að framleiða umrædd gaddaprótein. Sú veira getur hins vegar hvorki fjölgað sér, né valdið sjúkdómi. Þegar bóluefnið hefur verið gefið fara genaupplýsingarnar úr adenóveirunni inn í frumur líkamans sem hefja framleiðslu á gaddapróteinum. Ónæmiskerfið lítur á þau sem framandi fyrirbæri og hefur varnir með því að framleiða mótefni og T-frumur gegn veirunni. Sú vörn mun síðar koma að gagni til að verja viðkomandi einstakling gegn sýkingu af völdum SARS-CoV-2-kórónuveirunnar, þar sem ónæmiskerfið kemur til með að þekkja veiruna og ráðast gegn henni; mótefni og T-frumur vinna saman að því að drepa veiruna, meina henni aðgang í frumur og drepa sýktar frumur, og þar með verja einstaklinginn gegn COVID-19.


 Krabbameinsfélagið undirbýr mikilvæga rannsókn
Krabbameinsfélagið undirbýr mikilvæga rannsókn
 Kostnaðurinn nemur allt að þremur milljörðum
Kostnaðurinn nemur allt að þremur milljörðum
 Kærir teiknara Vísis til siðanefndar
Kærir teiknara Vísis til siðanefndar
 Húsnæðisstuðningur framlengdur til áramóta
Húsnæðisstuðningur framlengdur til áramóta
 Fannari líst ágætlega á aðgerðirnar
Fannari líst ágætlega á aðgerðirnar
 „Okkur mun ekki bregða“
„Okkur mun ekki bregða“
 Þyrla forsetans lenti í „slysi“
Þyrla forsetans lenti í „slysi“
 Telur að Rússar herði sókn sína í norðaustri
Telur að Rússar herði sókn sína í norðaustri